
par Simon Davies
Sentral en cimica es la table periodal, formulada en la sentenio 19. On ia comprende plu bon sua organiza en la sentenio 20, cuando on ia esplica la strutures de atomes. La table resoma la cualias de la elementos cimical e presenta la relatas familial cual esiste entre los, an entre elementos cual pare surfasal multe diferente. Esta similias pertine a la strutures de atomes.
Atomes ave un strutur notable simple, cual clari perce alga combinas de atomes es permeteda e otras es nonposible. Un atom conteni un nucleo ensircada par un nube de eletrones. La nucleo ave un carga eletrical positiva; la eletrones es negativa; e esta cargas oposada atrae lunlotra. Atomes es multe peti, ma un nucleo es an plu pico. Si un atom ta ave la grandia de un stadion, la nucleo ta es como un mosca.
Un nucleo es composada de particulas suatomal de du tipos: protones e neutrones. Protones es positiva cargada, ma neutrones ave no carga eletrical. Estra esta difere, protones e neutrones es multe simil, tan forte tenida a lunlotra ce los pote es separada par sola un esplode nucleal o cosa simil. (La nucleo conteni ance mesones, ma nos pote iniora los asi.)
La elementos coresponde a la identias cimical de la atomes, definida par la cuantia de protones en la nucleo. Un atom de idrojen ave 1 proton, elio ave 2, carbono ave 6, osijen ave 8 … e tal continuante asta oganeson, de cual cada atom ave 118 protones. Esta numeros es nomida la numeros atomal de la elementos, e longo los la elementos formi un serie – en cual cimicistes ia identifia un elemento per cada numero. La nucleo resta jeneral noncambiada, e donce reatas cimical no pote cambia un elemento a un otra, an si la alcimicistes antica e medieval ia espera lo.
La nucleo conteni cuantias simil de neutrones e de protones, ma la cuantia de neutrones pote varia, sin cambia la numero atomal. Tal, la mesma elemento pote ave atomes con cuantias pico diferente de neutrones, e donce con masas pico diferente. Esta varias de un elemento es nomida isotopos (de parolas elinica cual sinifia “egal” e “loca”) car on rejistra los a la mesma loca como lor elemento fundal en la table periodal.
Idrojen ave tre isotopos en la natur: la fundal e la plu abundante ave 1 proton sin neutrones; deuterio ave 1 proton e 1 neutron; e tritio ave 1 proton e 2 neutrones. Deuterio es ance nomida “idrojen pesosa”: cada atom ave sirca la duple de la pesa de idrojen comun. Con osijen lo formi “acua pesosa”. Tritio es radioativa: sua nucleo es nonstable.
La cuantia de protones determina la carga de la nucleo e donce ance la cuantia de eletrones cual ensirca lo. Un eletron ave la mesma cuantia de carga eletrical como un proton, ma negativa. E tal, cuando un atom es eletrical neutra, lo ave tan multe eletrones como protones – denova la numero atomal. Idrojen ave fundal 1 eletron, e carbono ave 6.
Eletrones es multe plu lejera ca protones e neutrones: lor masa es sirca 1/1836 de lo de un proton, donce lor presentia afeta apena la masa de la atom cual conteni los. Ma los ave un efeto profonda a la cualias cimical e fisical de un elemento, e cuasi tota cual aveni en cimica pertine a lor condui.
Los ensirca la nucleo en stratos de nubes, metafor simil a la nubes de la atmosfera, ma covrente la atom intera. Cada nube es un fenomeno de probablia: do lo es densa, ala on va trova probable un eletron; do lo es plu rarida, ala la eletron es min probable trovable. La move de eletrones crea un campo de enerjia cual pleni la atom intera, estra la nucleo. Lo no es vera ce la plu de un atom es un spasio vacua, an si esta es comun diseda.
La leges de mecanica cuantal dise ce la strato la plu basa (la plu prosima a la nucleo) pote conteni asta 2 eletrones, la strato seguente pote conteni asta 8, e la numero tre pote ave asta 18. En idrojen la eletron solitar ensirca la nucleo. De la 6 eletrones de carbono, 2 formi la strato interna e 4 otras abita la strato plu esterna.
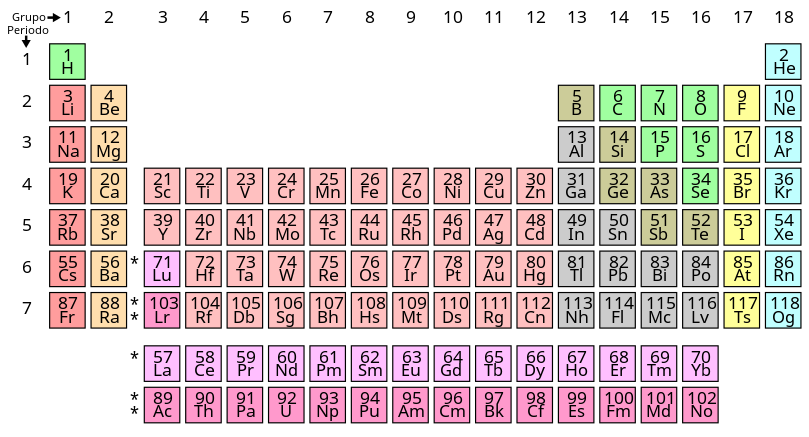
A la angulo alta sinistra de la table periodal, on trova idrojen (H); elio (He) apare a la alta destra. La strato prima de nubes es ja plenida, e esta completi la linia (o periodo) prima de la table. La eletron tre, parteninte a la elemento litio (Li), comensa un nube en la strato du. Ajuntante eletrones, nos traversa la table de sinistra a destra, pasante carbono (C) e osijen (O) entre otras, e nos completi esta strato con neon (Ne) – un gas, como elio a supra. Pos esta, nos debe comensa un plu nube con la eletron seguente, pertinente a sodio (Na), un elemento cual es multe simil a litio supra se.
Litio e sodio ave sola un eletron estra lor stratos completida de nubes. En la mesma modo, la elementos en cada colona (o grupo) ave scemas multe simil de nubes. Tal es la relatas familial entre la elementos, e on nomi esta la lege periodal. (La stratos esterna de la elementos en periodos 2 e 3 de la table es capas de teni 8 eletrones; los en periodos 4 e 5 es capas de teni 18.)
A cimicistes, plu interesante ca atomes individua es la composadas cual atomes formi con lunlotra. On ia identifia e nomi miliones de los. Esta colie enorme de composadas es lo cual crea la ricia de nosa ambiente.
Atomes lia a lunlotra car los pote redui sua enerjia si los susede completi un strato de nubes de eletrones. Un atom pote completi un strato en modos diversa. La prima es par perde eletrones de sua strato esterna. Un atom tende fa esta si acel strato no conteni ja multe eletrones – pd. si lo parteni a un elemento a sinistra de la table periodal. O, si lo ave ja ala multe eletrones – pd. en un elemento a destra – lo pote gania eletrones per completi la cosa.
Un otra manera en cual atomes completi lor stratos es par comparti eletrones entre se. Esta pote aveni cuando la perde plen de un eletron ta dona no vantaje de enerjia. Carbono, con 4 eletrones en sua strato esterna, tende lia par esta metodo media.
Cuando un atom gania o perde un eletron, lo deveni eletrical cargada, e tal atomes es nomida iones (de la parola elinica per “vadente”, car los move en responde a un campo eletrical). Un atom cual ia gania eletrones ave un carga negativa e on nomi lo un anion; un atom cual ia perde eletrones ave un carga positiva e on nomi lo un cation. Elementos a sinistra de la table tende deveni cationes; los a destra tende deveni aniones.
Per esemplo, considera clorido de sodio, comun conoseda como la spise sal. Un atom de sodio ave un eletron esterna; un atom de cloro (Cl), con 7 eletrones esterna, ave sola un loca vacua. La sola combina posible aveni cuando la atom de sodio “dona” sua eletron esterna a la atom de cloro, tal ce ambos deveni iones (Na⁺ e Cl⁻). Car cargas oposada senti un atrae resiproca, los junta se a lunlotra per formi NaCl. Esta formula indica ce la iones es presente en la proportio 1:1. Composadas como Na₂Cl (2:1) o Na₂Cl₃ (2:3) no pote esiste en ambientes normal.
On nomi esta spesie de junta un lia ional. Lo produi tipal solidas rijida ma frajil, cual fonde sola a temperatures alta. La minerales calcario e fluorita es sustantias ional liada. Nos pote sta sur tal rocas sin afonda car lor stratos de eletrones es completida, e donce la nubes de nosa atomes no pote ocupa la mesma spasio como la nubes de lores. Ance nosa osos es xef liada en modo ional.
Ma nosa organos e carne, la vestes cual covre nos e la plantas cual covre la rocas es de tipo diferente. Lor atomes comparti eletrones en lias covalente (un parola latina cual sinifia leteral “fortinte lunlotra”).
Considera un molecula de acua, con la formula H₂O. Un atom de osijen, con 6 eletrones esterna, pote aseta 2 plu. Un atom de idrojen ave sola 1 eletron, ma si du tal atomes es presente, los pote comparti lor 2 eletrones con la osijen, tal ce esta atom completi sua strato de 8 eletrones. En ajunta, la atom de osijen comparti 2 de sua propre eletrones con la atomes de idrojen – un con cada – tal completinte lor stratos de 2.
Acua no pote es H₃O o HO₂. La sola scema de lia cual produi stratos esterna completa, per tota la atomes partisipante, es H₂O. Simil es amonia (NH₃). N es nitrojen, de cual un atom ave 5 eletrones esterna e desira 3 plu, cual lo reseta en comparti con 3 atomes de idrojen – e lo mesma comparti un eletron con cada de estas. Ance simil es metano (CH₄), car carbono ave 4 locas vacua.
On vide ce lias covalente envolve sempre la comparti de duples de eletrones. Si on ave un sola tal duple, on parla de un lia unuple (scriveda como “–” en scemas); si on ave du tal duples en un lia, on dise ce la lia mesma es duple (”=”); e con tre, on ave un lia truple (“≡”). En acua, cada atom de idrojen es juntada a la atom de osijen par un lia unuple. Diosido de carbono (CO₂), par contrasta, ave du lias duple: sua scema es O=C=O. Lias truple es relativa rara.
La importa fundal de duples de eletrones es relatada con la fato ce tota eletrones jira. Du eletrones pote redui sua enerjia si los jira en dirijes oposada, tal fisante sua jiras a lunlotra. A esta, lo pertine ance ce la cuantia de eletrones tenable par cualce strato de un atom es sempre un numero duable (pe. 2, 8 e 18).
Lias covalente crea moleculas. Lias ional crea blocos de sustantia. Per esta razona on no pote ave un gas ional liada. Tota composadas ional es solida a temperatures comun, ma no cada solida es ional. Un esemplo de un solida cual es covalente liada es la zucar sucrosa (C₁₂H₂₂O₁₁), de cual cada molecula es un rede complicada de lias covalente entre atomes de carbono, idrojen e osijen. Cuasi tota sustantias licuida a temperatures comun – acua, per esemplo – es moleculal: esta permete la licuida a flue, con la moleculas pasante lunlotra sin deveni trapida par cualce atrae forte a lor visinas.
On ave un tipo tre de lia. La plu de elementos es metales: aluminio, arjento, cupre, fero, oro etc. Tota la atomes en un bloco metal es la mesma, donce lo es multe nonprobable ce un dui de los va formi cationes en cuando la otra dui va formi aniones. Esta sinifia ce metales no es ional liada. Si los ta es covalente liada, los ta es rijida e frajil. Ma en realia on pote bate los a formas nova, o estende los a filos.
Atomes metal es juntada par lias metal. Los no ave multe eletrones en la stratos esterna, e los tende perde estas. On pote imajina ce esta eletrones formi un spesie de mar (un campo eletrical) tra la bloco intera de la metal. La cationes restante es simil a rocas en esta mar negativa, ma interatante con lo per agrega se a un masa solida.
La masa es martelable car (como un mar vera) lo pote responde sin problem cuando la cationes es moveda par bates. Car la eletrones en la mar no es fisada a atomes individua, los migra tra la solida cuando los es repulsada par un flue de otra eletrones cual entra; en otra parolas, los es capas de conduta un corente eletrical. E lor campos eletrical impedi ondas eletromagnetal de lus, refletante alga de la lus a nosa oios.
La elementos cual es natural metales es los cual perde fasil eletrones. Estas es ance la elementos cual formi cationes en la presentia de elementos cual formi aniones, pd. la elementos a destra de la table periodal. Composadas ional, como la spise sal, es tipal formida entre un elemento metal e un elemento nonmetal.
Esta paje es presentada con la lisensa CC Attribution-Share Alike 4.0 International.
Lo ia es automata jenerada de la paje corespondente en la Vici de Elefen a 9 desembre 2025 (09:50 UTC).